
Posologie et administration1
La posologie recommandée d’ASPARLAS® est de 2500 unités/m2 administrées par perfusion intraveineuse, les doses étant espacées de 21 jours au minimum1.
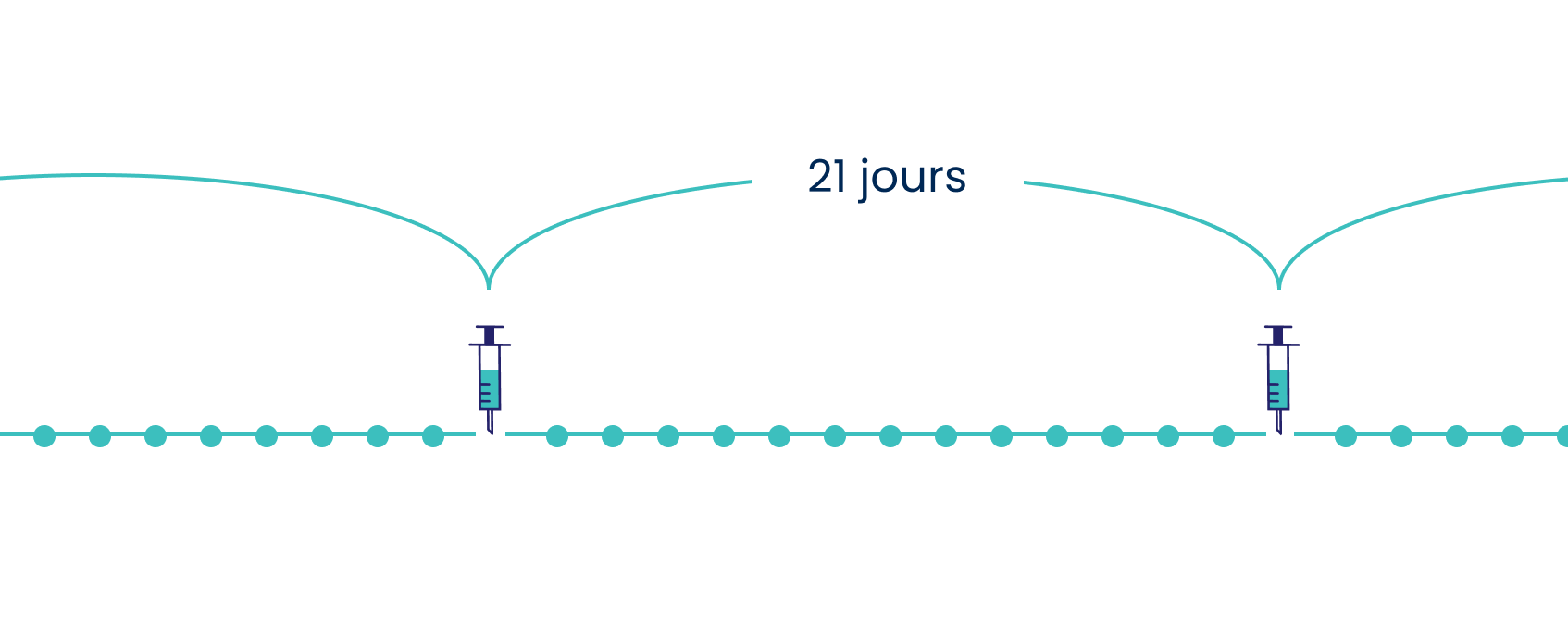
Adapté de la monographie d’ASPARLAS®. Veuillez consulter la monographie d’ASPARLAS® pour obtenir des renseignements complets sur la posologie.
- ASPARLAS® est une solution limpide et incolore sans agent de conservation. Avant l’administration, vérifier si le produit contient des particules, ou s’il est trouble ou décoloré. Dans l’un des trois cas, jeter la fiole. Ne pas administrer ASPARLAS® si la fiole a été agitée ou brassée vigoureusement, si elle a été congelée ou si elle a été laissée à la température ambiante pendant plus de 48 heures.
- Diluer la solution d’ASPARLAS® dans 100 mL de solution de chlorure de sodium à 0,9 % ou de dextrose à 5 % avant de l’administrer par perfusion intraveineuse d’une durée de 1 à 2 heures dans une perfusion déjà en cours.
- Après dilution, administrer immédiatement la solution par la tubulure d’une perfusion de chlorure de sodium à 0,9 % ou de dextrose à 5 % en cours.
Administrer pendant une période de 1 à 2 heures.
Ne pas administrer d’autres médicaments par la même tubulure de perfusion intraveineuse durant l’administration.
Au moins toutes les semaines, exercer une surveillance des patients, notamment en réalisant un dosage de la bilirubine, des taux de transaminases et du glucose de même qu’un examen clinique, jusqu’au rétablissement à la suite du cycle de traitement.
En cas de survenue d’un effet indésirable, il faut modifier le traitement en conséquence conformément à la monographie du produit.
- ASPARLAS® est utilisé dans le cadre de protocoles de chimiothérapie en association avec d’autres agents antinéoplasiques.
- ASPARLAS® n’est pas un médicament de remplacement bioéquivalent à la pegaspargase.
- Dans le cadre d’un schéma de polychimiothérapie, l’administration d’ASPARLAS® à la même dose et à la même fréquence que celles appliquées à la pegaspargase peut amplifier les effets toxiques en raison de la plus longue demi-vie du calaspargase pégol.
Veuillez consulter la monographie du produit pour obtenir des renseignements complets sur la posologie et l’administration.
En savoir plus sur les options thérapeutiques de Servier Canada pour la LAL
Consulter la monographie de produit d’ASPARLAS®
BFMr : schéma thérapeutique renforcé de Berlin-Frankfurt-Münster ; LAL : leucémie aiguë lymphoblastique ; ALP : phosphatase alcaline ; ALT : alanine aminotransférase ; aPTT : temps de thromboplastine partielle activée ; AST : aspartate aminotransférase ; BFM : Berlin-Francfort-Münster ; LCR : liquide céphalo-rachidien ; CTCAE : critères communs de terminologie pour les événements indésirables ; DFCI : Dana-Farber Cancer Institute ; IM : intramusculaire ; IV : intraveineux ; NCCN : National Comprehensive Cancer Network® ; NAAP : activité plasmatique minimale de l’arparaginase ; NAAS : activité sérique minimale de l’asparaginase ; AINS : anti-inflammatoire non stéroïdien ; PD : pharmacodynamique ; PK : pharmacocinétique
* La portée clinique n’a pas été établie.
† Cas fictifs. Peut ne pas être représentatif de tous les patients.
‡ La portée clinique comparative n’a pas été prouvée.
Références :
- Monographie du produit ASPARLAS®. Servier Canada.
- Données internes. Servier Canada. [[« Faites confiance à Asparlas »]]
- Monographie du produit ONCASPAR®. Servier Canada.
- Monographie du produit RYLAZEMC. Jazz Pharmaceuticals Canada Inc.
- Gouvernement du Canada. Sommaire des motifs de décision portant sur Asparlas. Disponible au https://pmps.hpfb-dgpsa.ca/documents-d-examen/ressource/SBD1718207489396 .
- Gouvernement du Canada. ONCASPAR_CPID Rédigé.
- Terwilliger T, Abdul-Hay M. Acute lymphoblastic leukemia: a comprehensive review and 2017 update. Blood Cancer J. 2017;7(6):e577.
- Mank V, Azhar W, Brown K. Leukocytosis. In: StatPearls. Treasure Island (FL): StatPearls Publishing; 21 avril 2024.
- National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology. Acute Lymphoblastic Leukemia, version 4.2023 – 5 février 2024.
- Vrooman LM et al. Efficacy and toxicity of pegaspargase and calaspargase pegol in childhood acute lymphoblastic leukemia: Results of DFCI 11-001. J Clin Oncol. 2021;39(31):3496–3505.
- National Institutes of Health. National Cancer Institute. Common Terminology Criteria for Adverse Events (CTCAE): Version 4.0. Disponible au : https://evs.nci.nih.gov/ftp1/CTCAE/CTCAE_4.03/Archive/CTCAE_4.0_2009-05-29_QuickReference_8.5×11.pdf. Consulté le 11 décembre 2024.
Restez en contact avec Servier Canada
Restez informé des informations sur les maladies, des options de traitement, de nos produits et de nos programmes de soutien aux patients.