Résultats de l’étude AALL07P41
L’activité de l’asparaginase
ASPARLAS® a démontré des données d’activité de l’asparaginase dans une étude ouverte menée en vue d’évaluer la pharmacocinétique, la pharmacodynamie, l’innocuité, l’immunogénicité et l’efficacité d’ASPARLAS® par rapport à la pégaspargase dans le cadre d’un schéma thérapeutique renforcé de BFM (Berlin-Frankfurt-Münster)1* :
Données d’efficacité
- 100 % des patients sous ASPARLAS® comparativement à 95,3 % dans le groupe sous pégaspargase présentaient une AAP ≥ 0,1 UI/mL jusqu’à 18 jours après l’administration de la dose d’induction.
- 92,9 % des patients sous ASPARLAS® comparativement à 29,5 % des patients sous pégaspargase présentaient une AAP ≥ 0,1 UI/mL 25 jours après l’administration de la dose d’induction.
Cette étude a été menée sur une population hors indication. ASPARLAS® est uniquement indiqué chez les patients âgés de 1 à 21 ans.
L’efficacité était démontrée sur la base de l’obtention et du maintien d’un nadir d’activité de l’asparaginase ≥ 0,1 UI/mL suivant l’administration de 2500 UI/m2 d’ASPARLAS® par voie intraveineuse, mesuré dans le plasma (NAAP) ou le sérum (NAAS), en supposant un rapport d’activité de l’asparaginase de 1:1 entre ces deux matrices. Ce seuil d’activité thérapeutique, après l’administration d’une dose unique ou à l’état d’équilibre, est considéré comme étant associé à une déplétion complète de l’asparagine d’après des données obtenues in vitro et lors d’études cliniques1.
Déplétion de l’asparagine
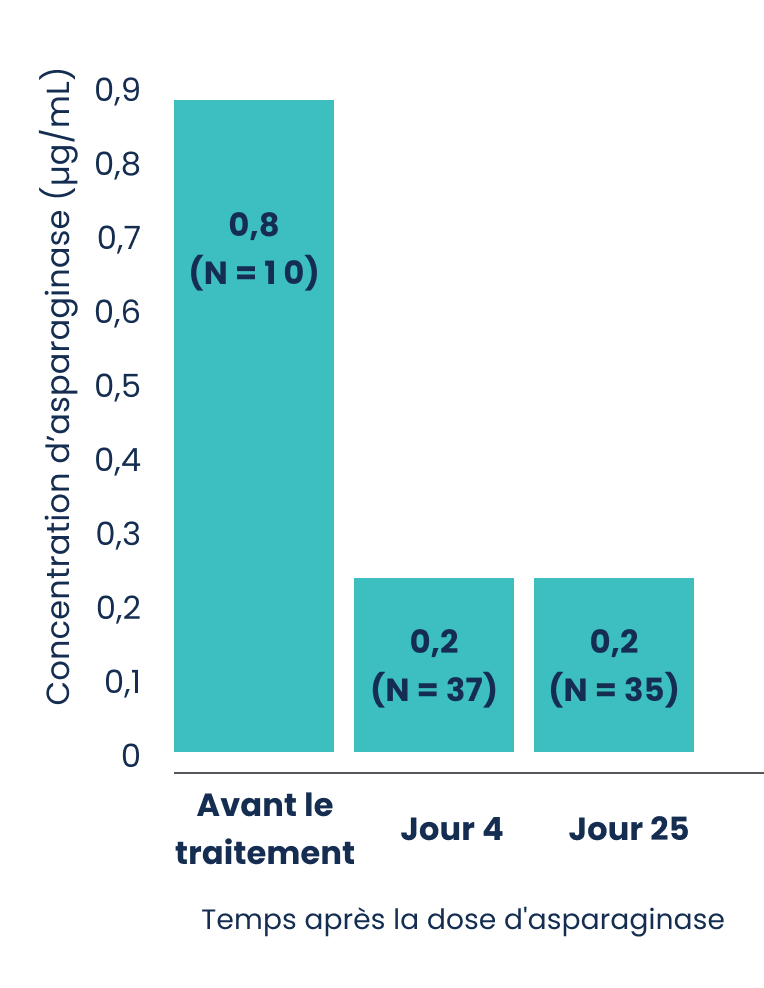
Pharmacodynamie‡
La réponse pharmacodynamique (PD) d’ASPARLAS® est liée à une déplétion soutenue de la L-asparagine1.
La concentration plasmatique d’asparagine chez les patients (N = 41; 1 à 26 ans) est demeurée sous la limite de quantification de la méthode de dosage pendant plus de 18 jours après l’administration d’une seule dose d’ASPARLAS® de 2500 UI/m2 pendant la phase d’induction de l’étude AALL07P41.
Cette étude a été menée sur une population hors indication. ASPARLAS® est uniquement indiqué chez les patients âgés de 1 à 21 ans.
BFMr : schéma thérapeutique renforcé de Berlin-Frankfurt-Münster ; LAL : leucémie aiguë lymphoblastique ; ALP : phosphatase alcaline ; ALT : alanine aminotransférase ; aPTT : temps de thromboplastine partielle activée ; AST : aspartate aminotransférase ; BFM : Berlin-Francfort-Münster ; LCR : liquide céphalo-rachidien ; CTCAE : critères communs de terminologie pour les événements indésirables ; DFCI : Dana-Farber Cancer Institute ; IM : intramusculaire ; IV : intraveineux ; NCCN : National Comprehensive Cancer Network® ; NAAP : activité plasmatique minimale de l’arparaginase ; NAAS : activité sérique minimale de l’asparaginase ; AINS : anti-inflammatoire non stéroïdien ; PD : pharmacodynamique ; PK : pharmacocinétique
* La portée clinique n’a pas été établie.
† Cas fictifs. Peut ne pas être représentatif de tous les patients.
‡ La portée clinique comparative n’a pas été prouvée.
Références :
- Monographie du produit ASPARLAS®. Servier Canada.
- Données internes. Servier Canada. [[« Faites confiance à Asparlas »]]
- Monographie du produit ONCASPAR®. Servier Canada.
- Monographie du produit RYLAZEMC. Jazz Pharmaceuticals Canada Inc.
- Gouvernement du Canada. Sommaire des motifs de décision portant sur Asparlas. Disponible au https://pmps.hpfb-dgpsa.ca/documents-d-examen/ressource/SBD1718207489396 .
- Gouvernement du Canada. ONCASPAR_CPID Rédigé.
- Terwilliger T, Abdul-Hay M. Acute lymphoblastic leukemia: a comprehensive review and 2017 update. Blood Cancer J. 2017;7(6):e577.
- Mank V, Azhar W, Brown K. Leukocytosis. In: StatPearls. Treasure Island (FL): StatPearls Publishing; 21 avril 2024.
- National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology. Acute Lymphoblastic Leukemia, version 4.2023 – 5 février 2024.
- Vrooman LM et al. Efficacy and toxicity of pegaspargase and calaspargase pegol in childhood acute lymphoblastic leukemia: Results of DFCI 11-001. J Clin Oncol. 2021;39(31):3496–3505.
- National Institutes of Health. National Cancer Institute. Common Terminology Criteria for Adverse Events (CTCAE): Version 4.0. Disponible au : https://evs.nci.nih.gov/ftp1/CTCAE/CTCAE_4.03/Archive/CTCAE_4.0_2009-05-29_QuickReference_8.5×11.pdf. Consulté le 11 décembre 2024.
Restez en contact avec Servier Canada
Restez informé des informations sur les maladies, des options de traitement, de nos produits et de nos programmes de soutien aux patients.