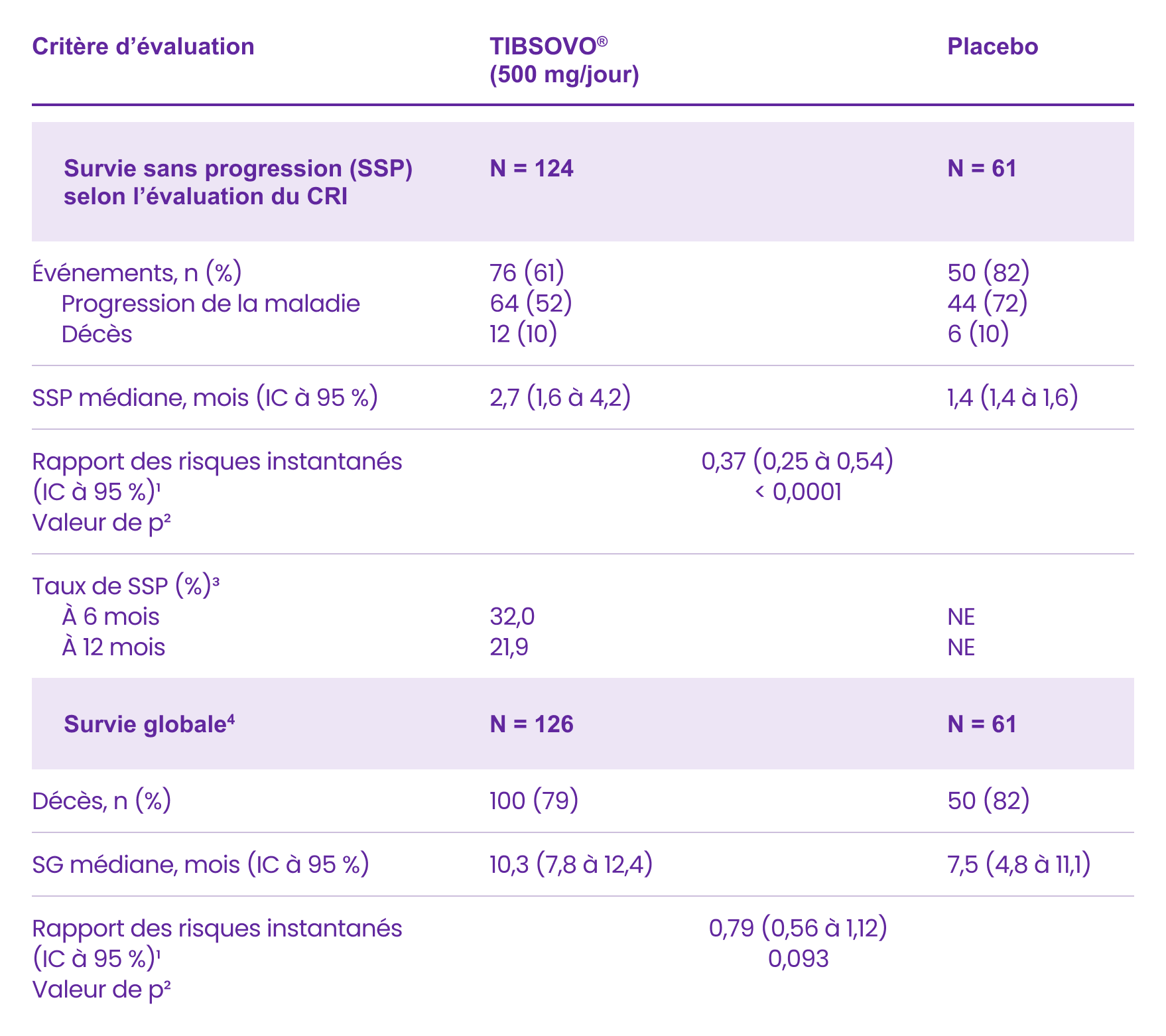
Étude CLARIDHY : Résultats clés liés à l’efficacité1
Données sur l’efficacité chez les patients ayant un cholangiocarcinome localement avancé ou métastatique

CRI : centre de radiologie indépendant; IC : intervalle de confiance; NE : non estimable.
1 Le rapport des risques instantanés est calculé à partir du modèle de régression de Cox stratifié. Le facteur de stratification est le nombre de schémas de traitement reçus dans le passé au moment de la randomisation.
2 La valeur de p est calculée à partir du test unilatéral de Mantel-Haenszel stratifié sans ajustement pour le changement de groupe (« permutation »). Le facteur de stratification est le nombre de schémas de traitement reçus dans le passé au moment de la randomisation. Page 34 de 45 TIBSOVO® (ivosidenib)
3 Selon l’estimation de Kaplan-Meier. Aucun patient randomisé dans le groupe placebo n’a survécu sans que la maladie progresse pendant 6 mois ou plus.
4 Les résultats de SG présentés correspondent à ceux de l’analyse finale de la SG (basée sur 150 décès; date limite de collecte des données : 31 mai 2020), qui a eu lieu 16 mois après l’analyse finale de la SSP (date limite de collecte des données : 31 janvier 2019).
Adapté de la monographie de produit de TIBSOVO®.
TIBSOVO® a démontré une amélioration de la SSP* par rapport au placebo.
TIBSOVO® a réduit de façon statistiquement significative le risque relatif instantané de progression ou de décès de 63% comparativement au placebo.
HR 0,37 ; IC à 95 %, 0,25–0,54 ; valeur p unilatérale < 0,0001
Courbe de Kaplan-Meier de la SSP selon le CRI
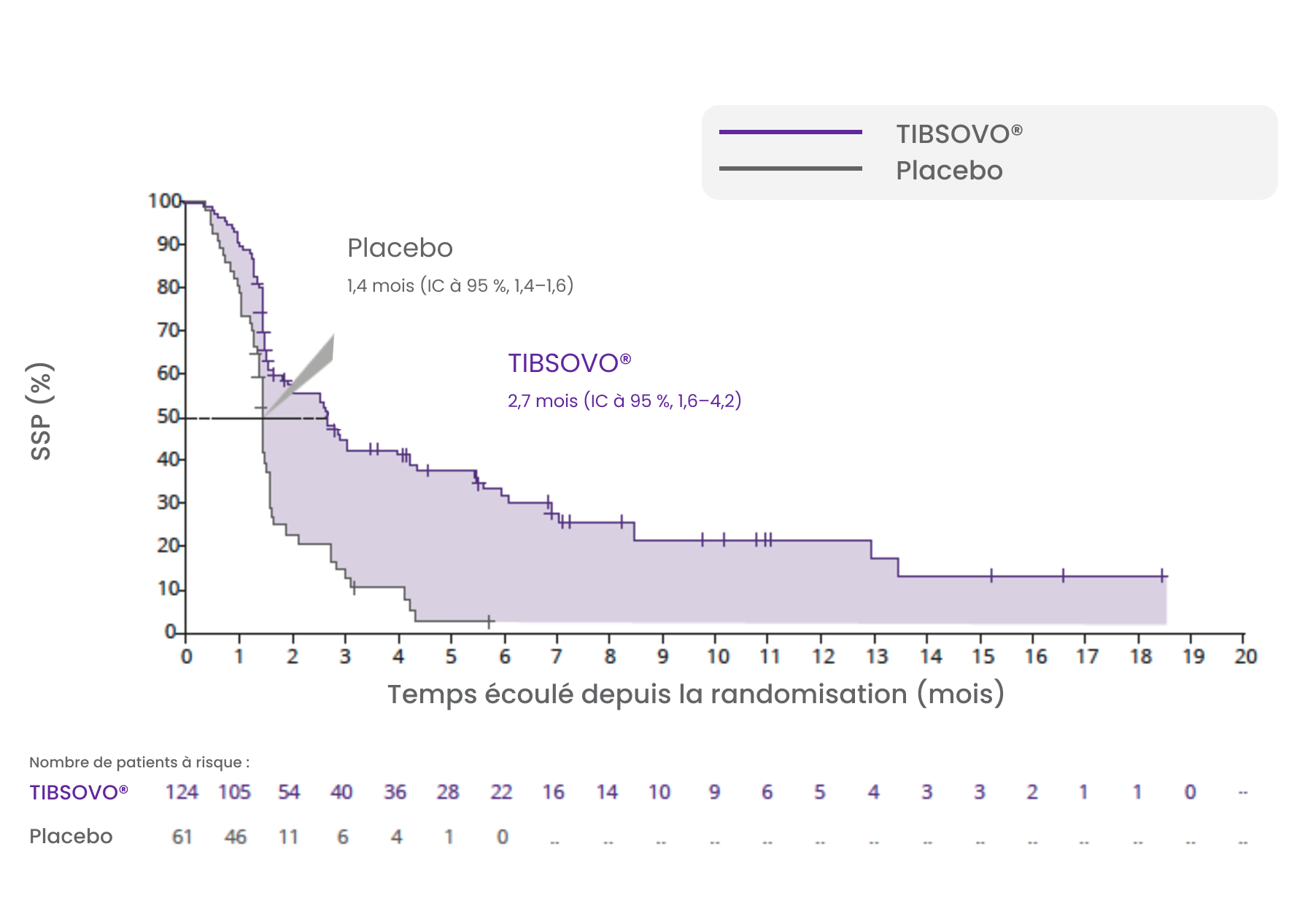
* La survie sans progression (SSP) est définie comme le temps écoulé entre la randomisation et la progression de la maladie ou le décès, quelle qu’en soit la cause.
Adapté de la monographie de produit TIBSOVO®.
Consultez la monographie de produit de TIBSOVO®
2-HG : 2-hydroxyglutarate ; α-CG : alpha-cétoglutarate ; LAM : leucémie aiguë myéloïde ; AZA : azacitidine ; CCA : cholangiocarcinome ; IC : intervalle de confiance ; RC : rémission complète ; RCh : rémission complète avec récupération hématologique partielle ; CTCAE : critères communs de terminologie pour les événements indésirables ; ECG : électrocardiogramme ; IF ECOG : indice fonctionnel selon l’Eastern Cooperative Oncology Group ; SSE : survie sans événement ; DFGe : débit de filtration glomérulaire estimé ; FEV1 : volume expiratoire maximal en 1 seconde ; HR : rapport de risque ; IDH1 : isocitrate déshydrogénase-1 ; CRI : centre de radiologie indépendant ; IV : intraveineux ; NCCN : National Comprehensive Cancer Network ; SG : survie globale ; PD : pharmacodynamie ; PK : pharmacocinétique ; RECIST : critères d’évaluation de la réponse dans les tumeurs solides ; SC : sous-cutané.
Références :
- Monographie de produit de TIBSOVO®. Servier Canada. 19 juillet 2024.
- Montesinos P, et al. N Engl J Med. 2022 Apr 21;386(16):1519–1531.
- National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology (Lignes directrices du NCCN®) Acute Myeloid Leukemia Version 2.2025 — January 27, 2025.
- National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology (Lignes directrices du NCCN®) Biliary Duct Cancers Version 6.2024 — January 10, 2025.
- Abou-Alfa GK, et al. Lancet Oncol. 2020 Jun;21(6):796-807.
- Zhu AX, et al. JAMA Oncol. 2021 Nov 1;7(11):1669-1677.
- Dammacco F, Silvestris F, eds. Oncogenomics: From Basic Research to Precision Medicine. Academic Press; 2019.
Restez en contact avec Servier Canada
Restez informé des informations sur les maladies, des options de traitement, de nos produits et de nos programmes de soutien aux patients.