
Posologie et administration dans la LAM1
Dans le traitement de la LAM, TIBSOVO® est administré en association avec l’azacitidine. Pour la posologie et le mode d’administration de l’azacitidine, veuillez consulter la monographie de produit de l’azacitidine.
Dose recommandée et administration de TIBSOVO®
Dose recommandée de TIBSOVO®
Pour le traitement de la LAM, la dose recommandée est de 500 mg de TIBSOVO® (2 comprimés dosés à 250 mg) prise par voie orale une fois par jour.

Mode d’administration de TIBSOVO®
Ne mangez rien dans les 2 heures qui précèdent et dans l’heure qui suit la prise de TIBSOVO®
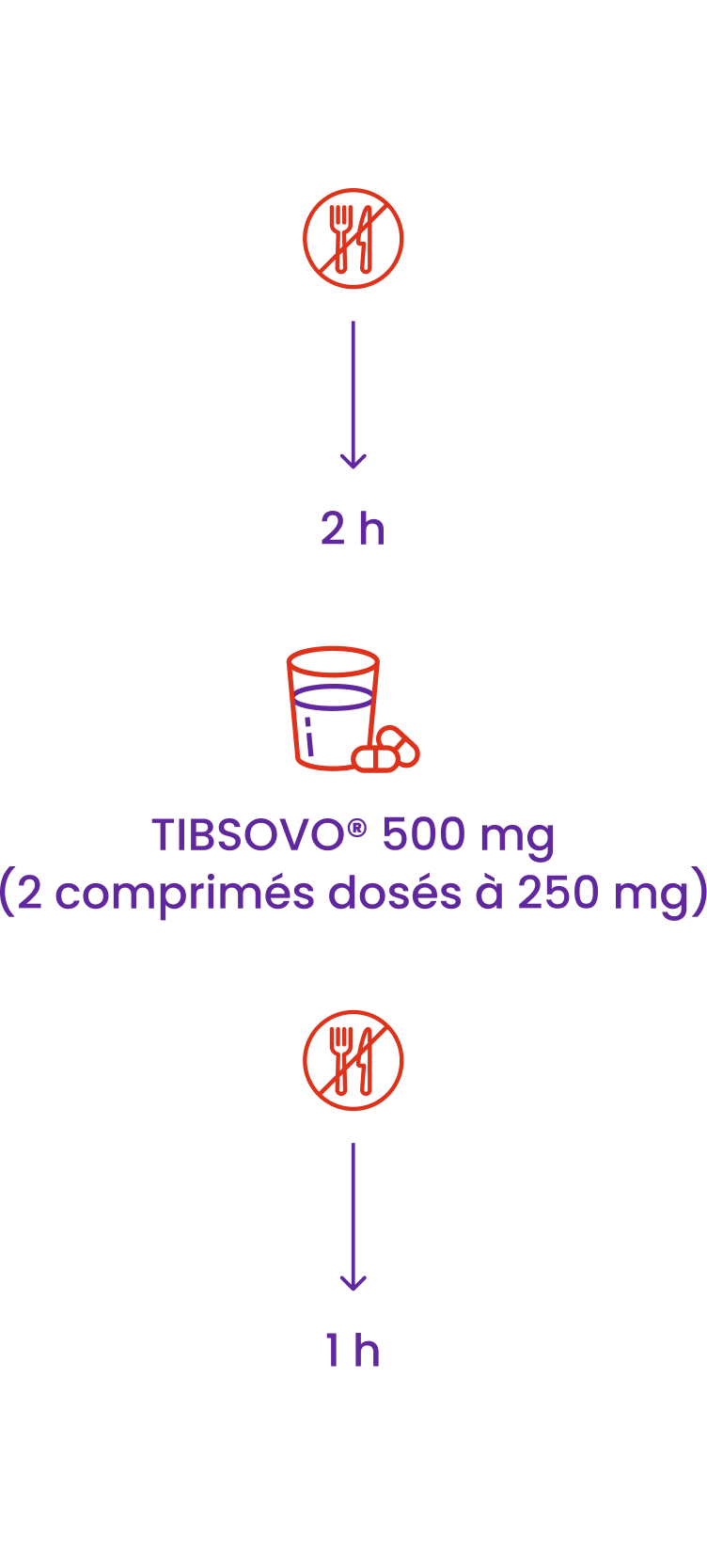
Prenez les comprimés par voie orale à peu près à la même heure chaque jour
Les comprimés doivent être avalés entiers avec de l’eau
Le pamplemousse et le jus de pamplemousse peuvent faire augmenter les concentrations plasmatiques de TIBSOVO®.
Le traitement doit se poursuivre jusqu’à la progression de la maladie ou jusqu’à ce que le patient ne tolère plus le médicament.
Adapté de la monographie de produit TIBSOVO®.
Veuillez consulter la monographie de produit TIBSOVO® pour les renseignements posologiques complets.
TIBSOVO® 500 mg une fois par jour (environ toutes les 24 heures) par voie orale
Adapté de la monographie de produit TIBSOVO®.
Veuillez consulter la monographie de produit TIBSOVO® pour les renseignements posologiques complets.
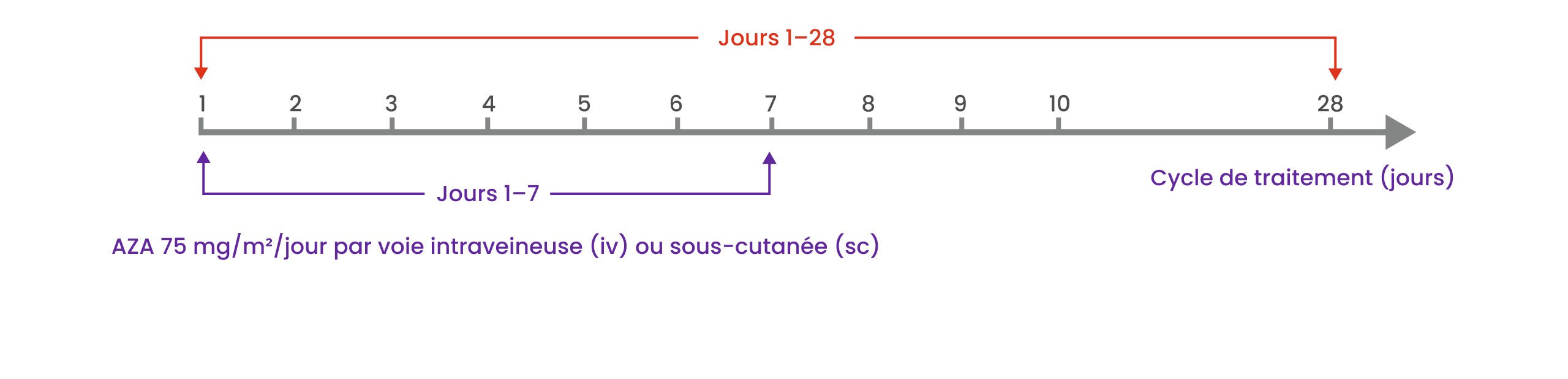
TIBSOVO® doit être pris le Jour 1 Cycle 1 et administré une fois par jour durant un cycle de 28 jour. Il doit être pris en association avec l’azacitidine à 75 mg/m² de surface corporelle, par voie intraveineuse ou sous-cutanée, une fois par jour les jours 1-7 de chaque cycle de 28 jours. Pendant le premier cycle de traitement, il faut administrer 100 % de la dose d’azacitidine.
Le traitement doit se poursuivre jusqu’à la progression de la maladie ou jusqu’à ce que le patient ne tolère plus le médicament.
Consultez la monographie du produit TIBSOVO®
2-HG : 2-hydroxyglutarate ; α-CG : alpha-cétoglutarate ; LAM : leucémie aiguë myéloïde ; AZA : azacitidine ; CCA : cholangiocarcinome ; IC : intervalle de confiance ; RC : rémission complète ; RCh : rémission complète avec récupération hématologique partielle ; CTCAE : critères communs de terminologie pour les événements indésirables ; ECG : électrocardiogramme ; IF ECOG : indice fonctionnel selon l’Eastern Cooperative Oncology Group ; SSE : survie sans événement ; DFGe : débit de filtration glomérulaire estimé ; FEV1 : volume expiratoire maximal en 1 seconde ; HR : rapport de risque ; IDH1 : isocitrate déshydrogénase-1 ; CRI : centre de radiologie indépendant ; IV : intraveineux ; NCCN : National Comprehensive Cancer Network ; SG : survie globale ; PD : pharmacodynamie ; PK : pharmacocinétique ; RECIST : critères d’évaluation de la réponse dans les tumeurs solides ; SC : sous-cutané.
Références :
- Monographie de produit de TIBSOVO®. Servier Canada. 19 juillet 2024.
- Montesinos P, et al. N Engl J Med. 2022 Apr 21;386(16):1519–1531.
- National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology (Lignes directrices du NCCN®) Acute Myeloid Leukemia Version 2.2025 — January 27, 2025.
- National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology (Lignes directrices du NCCN®) Biliary Duct Cancers Version 6.2024 — January 10, 2025.
- Abou-Alfa GK, et al. Lancet Oncol. 2020 Jun;21(6):796-807.
- Zhu AX, et al. JAMA Oncol. 2021 Nov 1;7(11):1669-1677.
- Dammacco F, Silvestris F, eds. Oncogenomics: From Basic Research to Precision Medicine. Academic Press; 2019.
Restez en contact avec Servier Canada
Restez informé des informations sur les maladies, des options de traitement, de nos produits et de nos programmes de soutien aux patients.
