Profil pharmacocinétique et pharmacodynamique
Profil pharmacocinétique (PK)1*
La demi-vie d’élimination moyenne d’ONCASPAR® était d’environ 5,3 jours après une seule perfusion intraveineuse1*.
Lors de l’étude DFCI 11-001, l’activité de l’asparaginase a été évaluée après l’administration d’une seule dose d’ONCASPAR® à 2 500 U/m2 de surface corporelle par voie intraveineuse pendant la phase d’induction, ainsi que toutes les deux semaines après la phase d’induction1*.
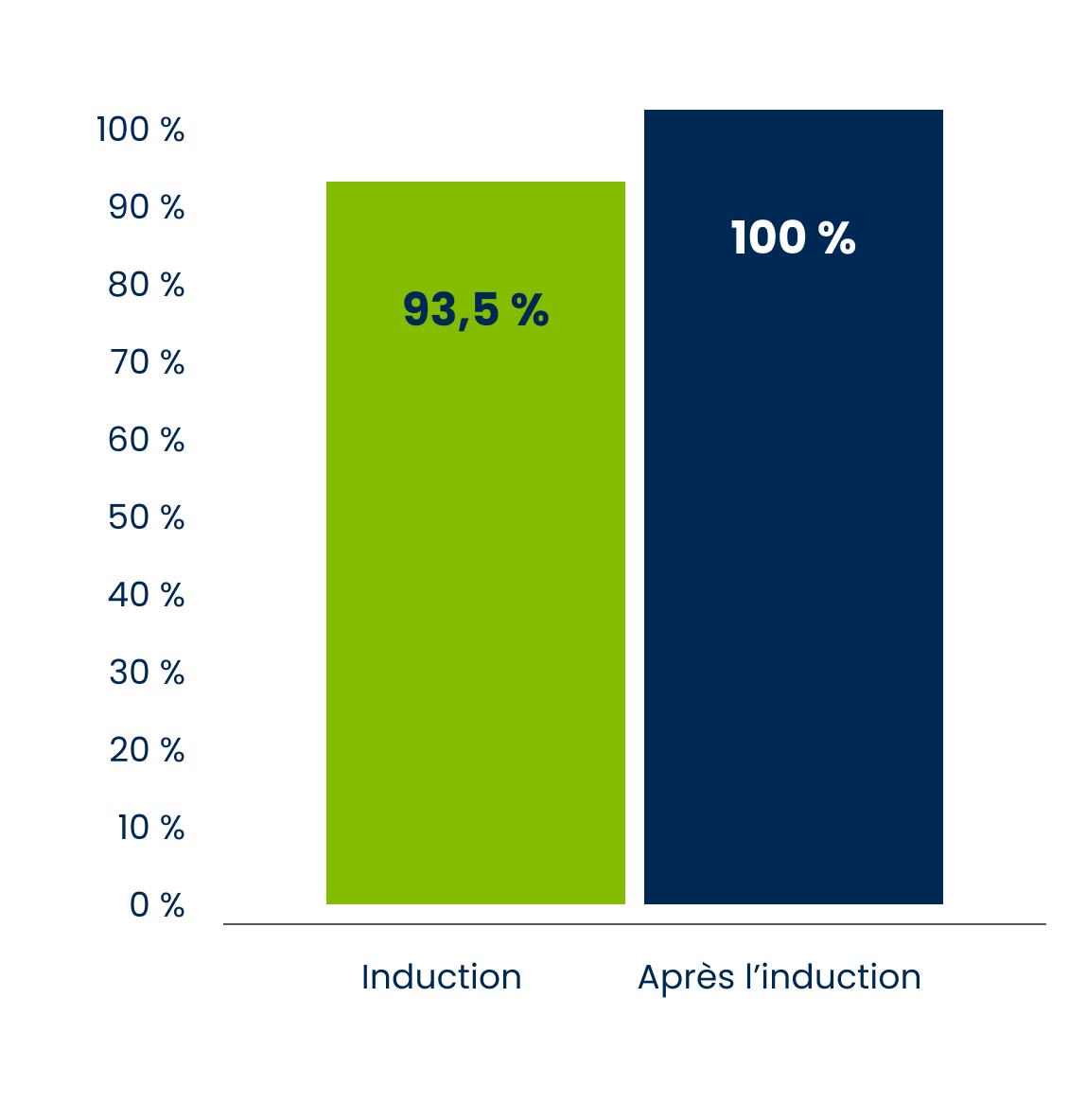
Activité de l’asparaginase dans le plasma dans le cadre d’une étude pharmacocinétique
Pendant la phase d’induction, l’activité de l’asparaginase plasmatique était maintenue à ≥ 0,1 U/mL 18 jours après l’administration chez 93,5 % des sujets.
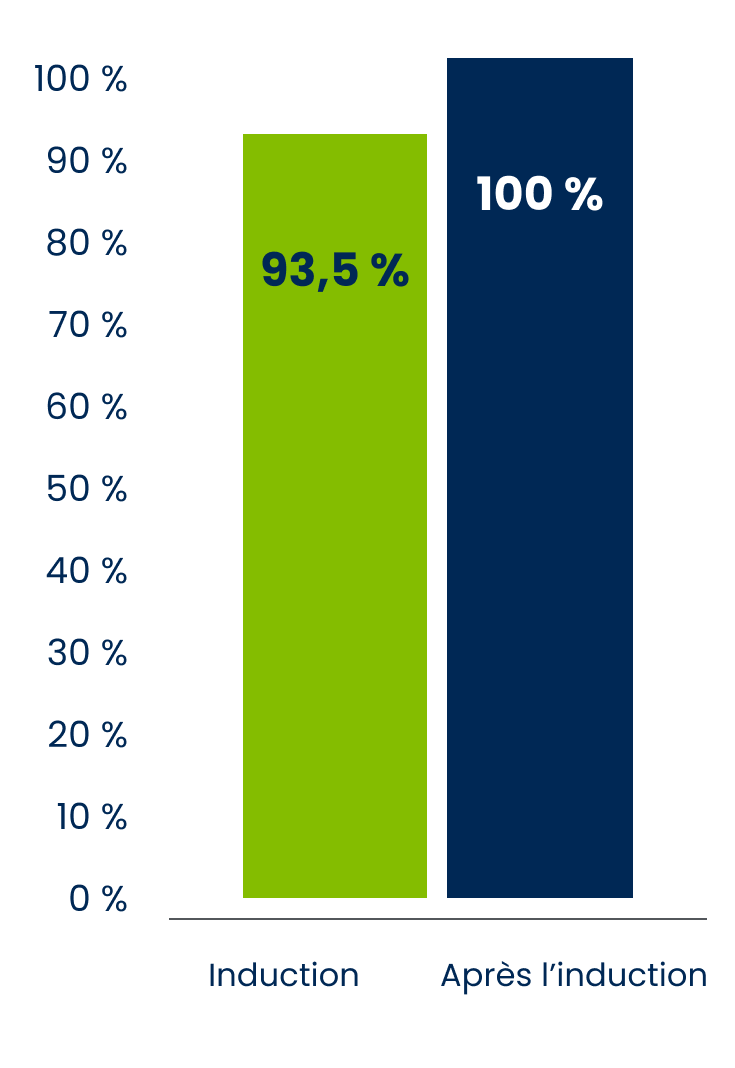
Après la phase d’induction, un nadir (creux) de l’activité de l’asparaginase était maintenu à plus de 0,4 U/mL de la 7e semaine jusqu’à la 25e semaine chez 100 % des sujets évaluables (n) (c.-à-d. n = 86 à la semaine 7, n = 84 à la semaine 13 et n = 78 aux semaines 19 et 25).
Adapté de la monographie du produit ONCASPAR®.
Ces résultats indiquent qu’une activité de l’asparaginase d’importance clinique s’est maintenue pendant tout l’intervalle posologique (c.-à-d. deux semaines) après l’administration d’ONCASPAR® à 2 500 U/m2 de surface corporelle toutes les deux semaines1*.
Profil pharmacodynamique (PD)1*
L’effet antileucémique de la L-asparaginase est lié à une déplétion soutenue de la L-asparagine dans le sang et le liquide céphalorachidien (LCR)1†.
Dans l’étude AALL07P4, l’effet pharmacodynamique d’ONCASPAR® a été évalué après son administration par voie intraveineuse :
L’effet d’ONCASPAR® a été mesuré auprès de 47 sujets évaluables atteints d’une LAL à précurseurs B à risque élevé qui ont reçu des doses d’ONCASPAR® de 2 500 U/m2 de surface corporelle par voie intraveineuse pendant les phases d’induction et de consolidation.
Déplétion de la L-asparagine dans le sang
Les concentrations plasmatiques de L-asparagine ont diminué jusqu’en dessous de la limite de quantification de l’épreuve dans les 24 heures suivant le traitement d’induction et la première dose du traitement de consolidation par ONCASPAR®. Cette déplétion s’est maintenue pendant environ deux semaines.

Déplétion de la L-asparagine dans le liquide céphalorachidien (LCR) :
- En outre, au 4e jour suivant l’administration de la dose du traitement d’induction, les concentrations d’asparagine dans le LCR avaient diminué; elles étaient encore indétectables au 25e jour suivant l’administration.
BFMr : schéma thérapeutique renforcé de Berlin-Frankfurt-Münster; LAL : leucémie aiguë lymphoblastique ; DFCI: Dana-Farber Cancer Institute; ELISA : méthode d’immuno-absorption enzymatique (de l’anglais enzyme-linked immunosorbent assay); i.m. : intramusculaire; i.v. : intraveineux; PD: pharmacodynamie; PK: pharmacocinétique; NCCN: National Comprehensive Cancer Network®.
* La portée clinique n’a pas été établie.
† La portée clinique comparative n’a pas été prouvée.
‡ Cas fictifs. Peut ne pas être représentatif de tous les patients.
§ La L-asparaginase native d’E. coli n’est pas disponible au Canada.
References:
- Monographie du produit ONCASPAR®. Servier Canada. 20 août 2024.
- ONCASPAR_CPID Redacted.
- Monographie du produit ASPARLAS®. Servier Canada. 8 mars 2024.
- Monographie du produit RYLAZETM. Jazz Pharmaceuticals Canada Inc.
- NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) for Acute Lymphoblastic Leukemia V.2.2024. Disponible sur : https://www.nccn.org/professionals/physician_gls/pdf/all.pdf. Consulté le 8 novembre 2024.
- Vrooman LM et al. Efficacy and toxicity of pegaspargase and calaspargase pegol in childhood acute lymphoblastic leukemia: Results of DFCI 11-001. J Clin Oncol. 2021;39(31):3496–3505.
Restez en contact avec Servier Canada
Restez informé des informations sur les maladies, des options de traitement, de nos produits et de nos programmes de soutien aux patients.